特异性KRAS G12D抑制剂在癌症治疗中的应用_abio生物试剂品牌网
Section.01
KRAS 突变和癌症
KRAS 基因突变在癌症中频发,包括胰腺导管腺癌、非小细胞肺癌和结直肠癌等 [1][2] 。最常发生的激活突变是在密码子 12 (G12) 、13 (G13) 、和 61 (Q61) 上的单核苷酸置换,其中绝大多数突变发生在 G12 上,G12D、G12C 和 G12V 则是最常见的突变亚型 [2][3] 。G12C 突变阻断 GAP 与 KRAS 的结合,从而抑制 GTP 水解并将 G12C 突变体 KRAS 锁定在其活性状态。活性 KRAS 通过 MAPK 和 PI3K 途径诱导信号转导,促进细胞增殖、生长和存活,从而促进肿瘤发生 [1][4] 。G12V 是第二常见的 KRAS 突变,它会导致 MAPK 通路的异常激活,并促进肿瘤的发生和转移。
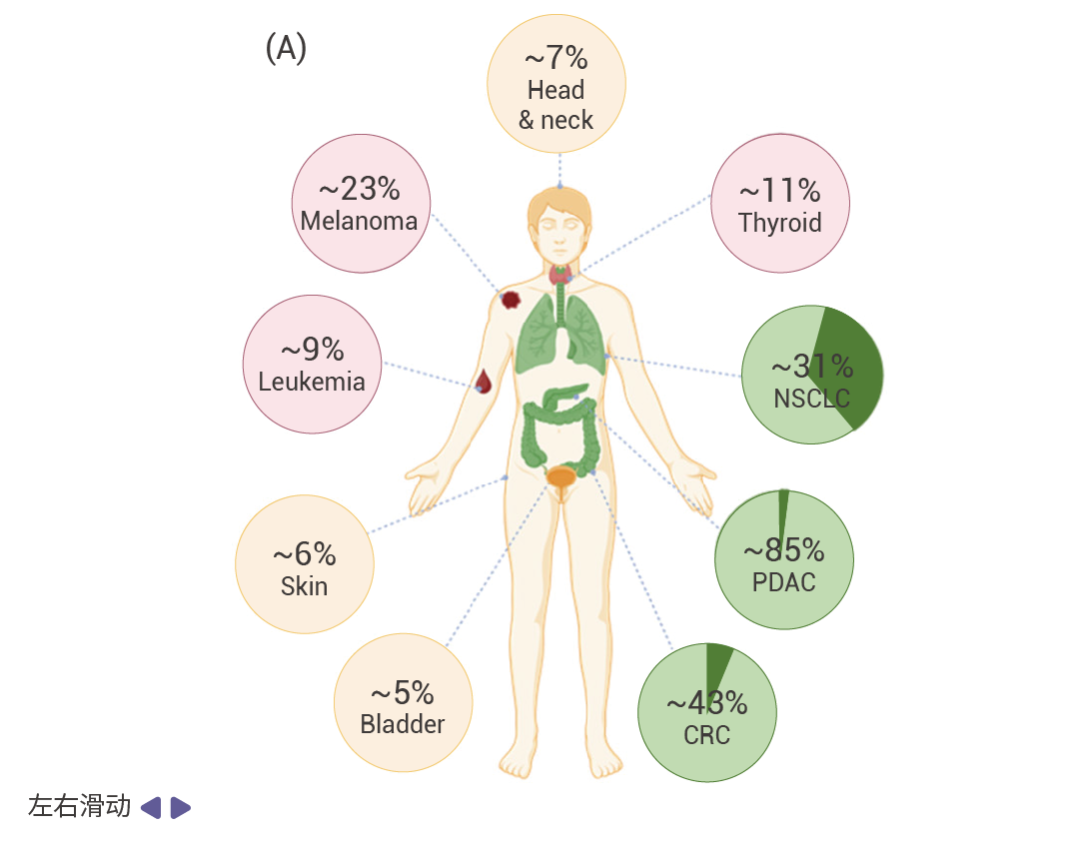
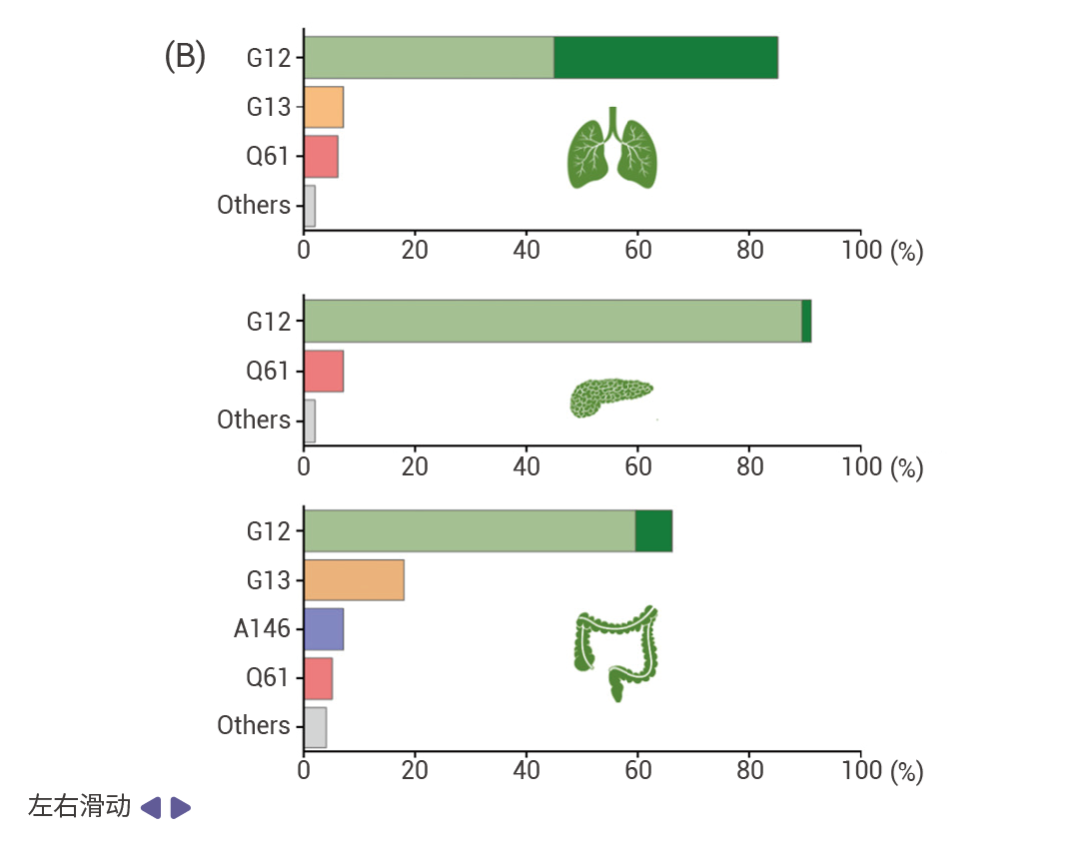
图 1. RAS 突变在各种主要癌症类型中的发生率 [5] 。
A.不同主要癌症类型中 KRAS (绿色), HRAS (黄色),和 NRAS (粉色) 突变频率的分布情况。 B. KRAS 突变亚型在癌症中的发生频率:上为非小细胞肺癌;中为胰腺导管腺癌;下为结直肠癌。
KRAS 属于大鼠肉瘤病毒癌基因 (Rat sarcoma viral oncogene family, RAS) 的家族成员之一,可将 GTP 水解为 GDP。在正常生理条下,在非活性 GDP 结合状态和活性 GTP 结合状态之间循环,将细胞外信号转导至细胞内部。受体酪氨酸激酶 (RTK) 激活后,鸟苷酸交换因子 (GEF) 与 KRAS 结合并促进结合的 GDP 交换为 GTP,从而将 KRAS 切换到活性状态[6]。GAPs 通过加强 GDP 和 KRAS 之间的结合来维持 KRAS 的非活性状态。
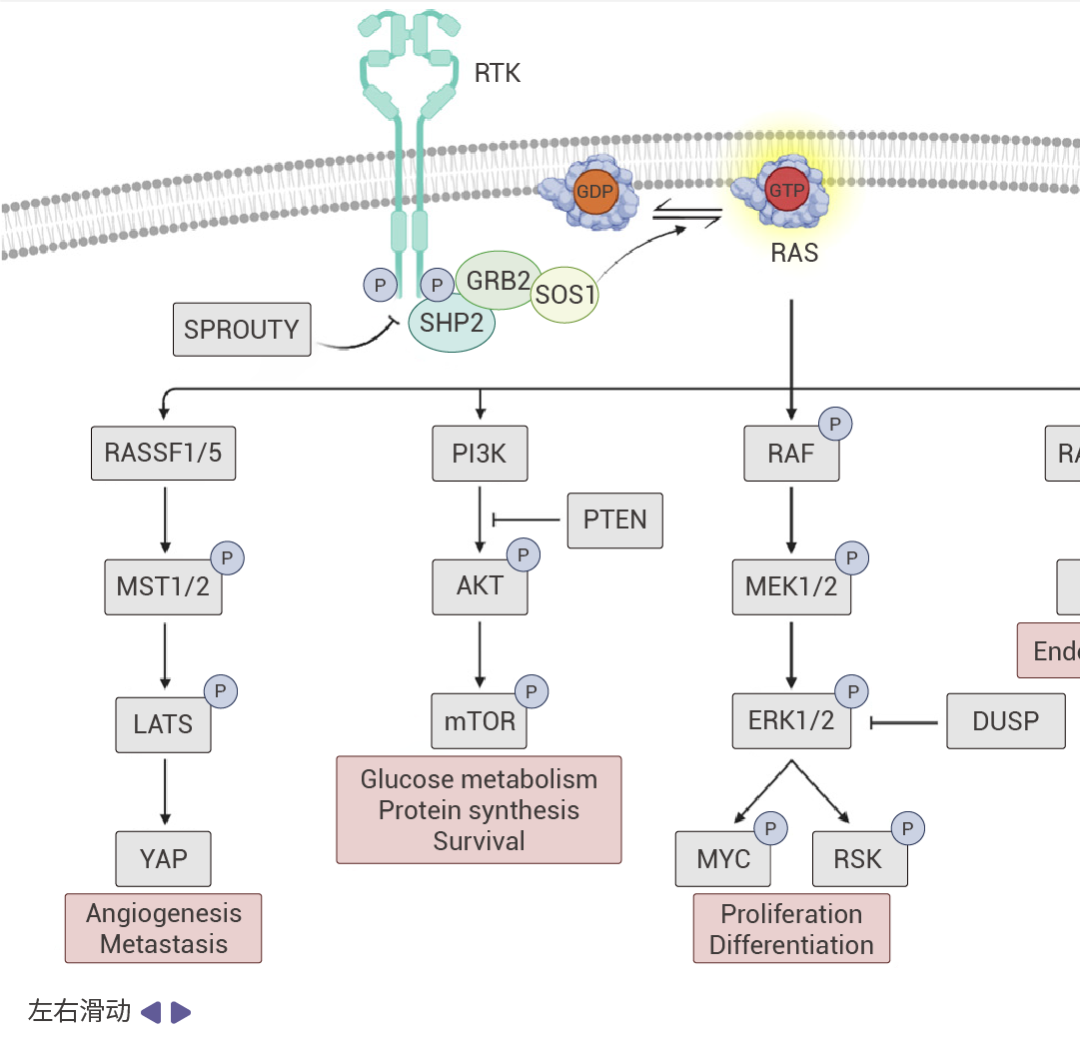
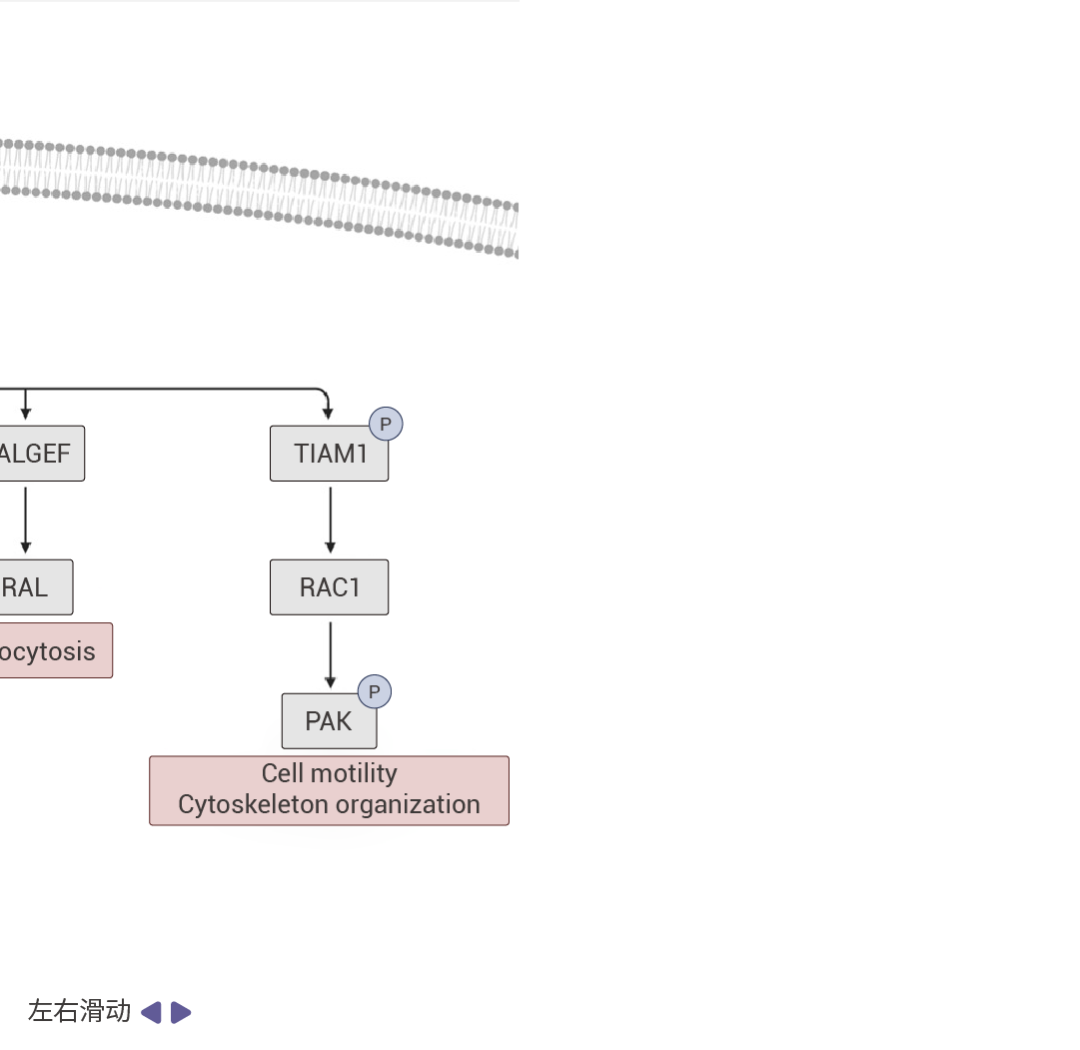
图 2. RAS 信号通路 [5] 。
受体酪氨酸激酶(RTKs)通过促进 GEF(如 SOS1)将 GDP 换成 GTP 的过程来促进 RAS 蛋白的激活。活跃的 RAS 会驱动众多促癌通路。
Section.02
成功靶向 KRAS G12C
KRAS 体积较小,表面光滑,导致小分子难以与 KRAS 结合。KRAS 表面除了 GTP 结合袋外,没有其他区域可以与小分子结合,但靶向 GTP 结合袋相当困难 [1] 。因此长久以来 KRAS 都被认为是 “不可成药” 的靶点。
switch-II 口袋的发现促进了临床应用的特异性 KRAS 抑制剂的发展,目前特异性 KRAS G12C 的抑制剂已被引入临床实践,其中 Sotorasib (AMG510) 和 Adagasib (MRTX849) 分别于 2021 年和 2022 年被 FDA 批准上市, Fulzerasib (GFH925) 在 2024 年首次获得中国批准。这 3 种药物被用于 KRAS G12C 突变的非小细胞肺癌 (NSCLC) 的治疗。
Sotorasib 和 Adagasib 的单药治疗在结直肠癌中的客观缓解率 (ORR) 均显著低于非小细胞肺癌。研究表明 EGFR 的激活是导致结直肠癌缓解率较低的原因之一,而同时使用 EGFR 抑制剂与 BRAF 抑制剂联合治疗则能够克服这一问题 [7] 。Sotorasib 与 Panitumumab ( 一种 EGFR 抑制剂) 联合使用可将无进展生存期 (PFS) 提高至 5.6 个月,而接受 trifluridine-tipiracil (三氟尿苷-替吡嘧啶) 或 Regorafenib (多靶点受体酪氨酸激酶抑制剂,抑制 VEGFR1/2/3,PDGFRβ,Kit,RET 和 Raf-1) 治疗的 KRAS G12C 突变型晚期结直肠癌患者组的 PFS 仅为 2.2 个月 [8] 。Adagrasib 与 Cetuximab (一种 EGFR 抑制剂) 联合使用时,客观缓解率也有所提高,达到 30.2% [9] 。基于这些发现,FDA 于 2024 年批准了这种联合疗法用于 KRAS G12C 突变型结直肠癌。
此外,目前几种间接的泛 KRAS 抑制剂(通过靶向调节 KRAS 活性的蛋白来实现调控 KRAS 活性) 正在临床开发阶段。勃林格殷格翰宣布了一种 SOS1(一种鸟嘌呤核苷酸交换因子) 抑制剂 BI-1701963 正处于临床一期试验阶段,它可以破坏 SOS1 介导的 KRAS 的核苷酸交换。此外,鉴于 SHP2 在 KRAS 激活过程中发挥了不可或缺的作用,一些 SHP2 抑制剂(如 TNO155、 RMC-4630 和 JNJ-3068) 正在进行早期临床试验[10]。
表 1. FDA 批准的 KRAS G12C 抑制剂临床试验
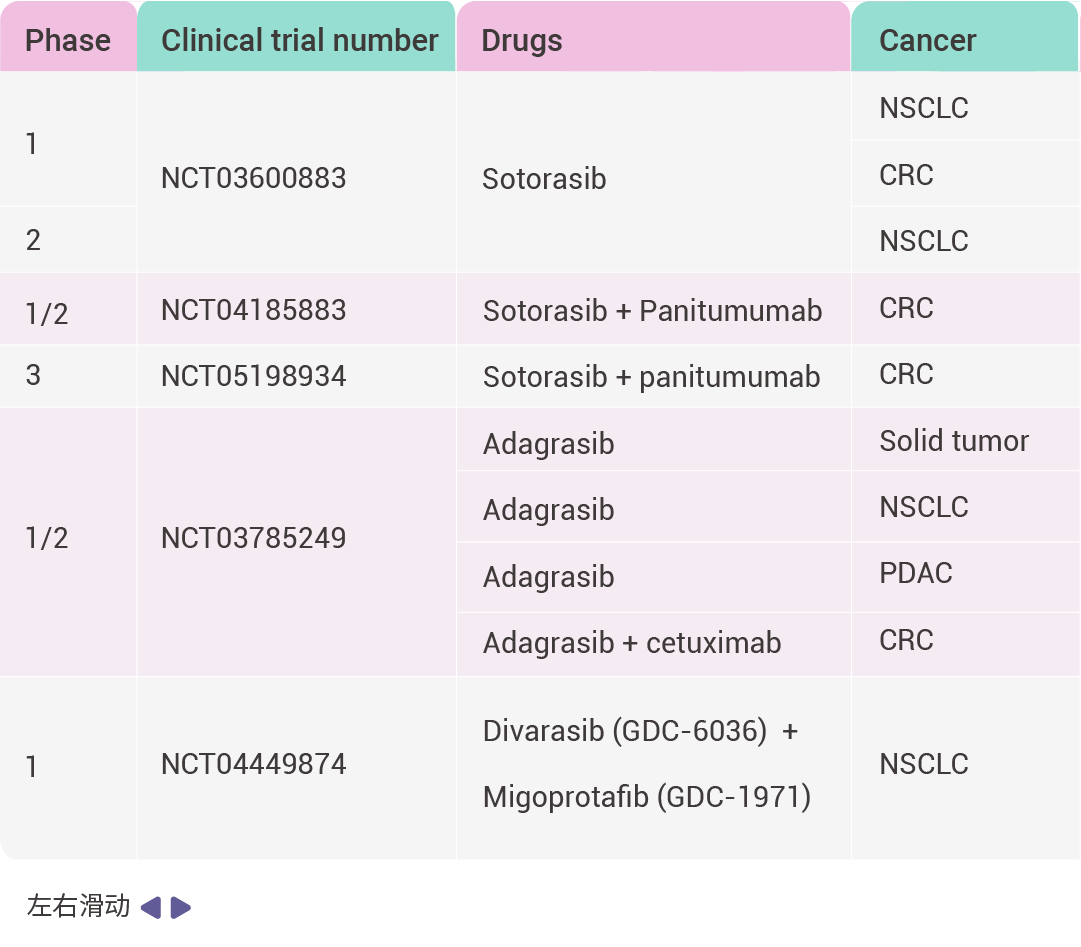
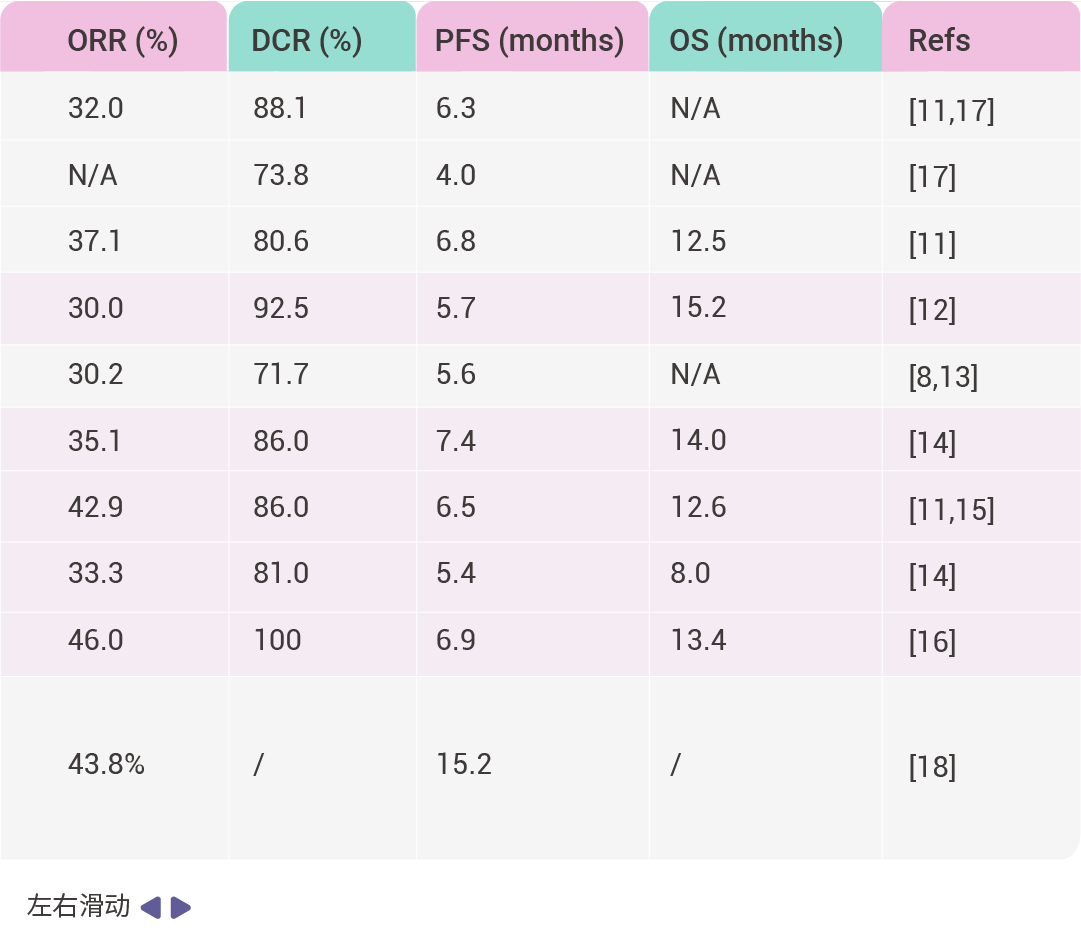
缩写词: objective response rate (ORR); progression-free survival (PFS); disease control rate (DCR); overall survival (OS).
Section.03
KRAS G12D 抑制剂
由于其他 KRAS 突变的高流行率,针对其他突变选择性抑制剂以及泛 KRAS 抑制剂的开发也在进行中,一部分新型 KRAS 抑制剂正在进行临床试验。特别是 KRAS G12D 已成为开发新型抑制剂的方向,因为该突变占所有 KRAS 突变的约 28%,并且是胰腺导管腺癌和结直肠癌中最常见的突变 [5] 。目前,还没有获得 FDA 批准的针对 KRAS G12D 的特异性抑制剂, KRAS G12D 突变的癌症代表着一个重要的未满足的医疗需求。
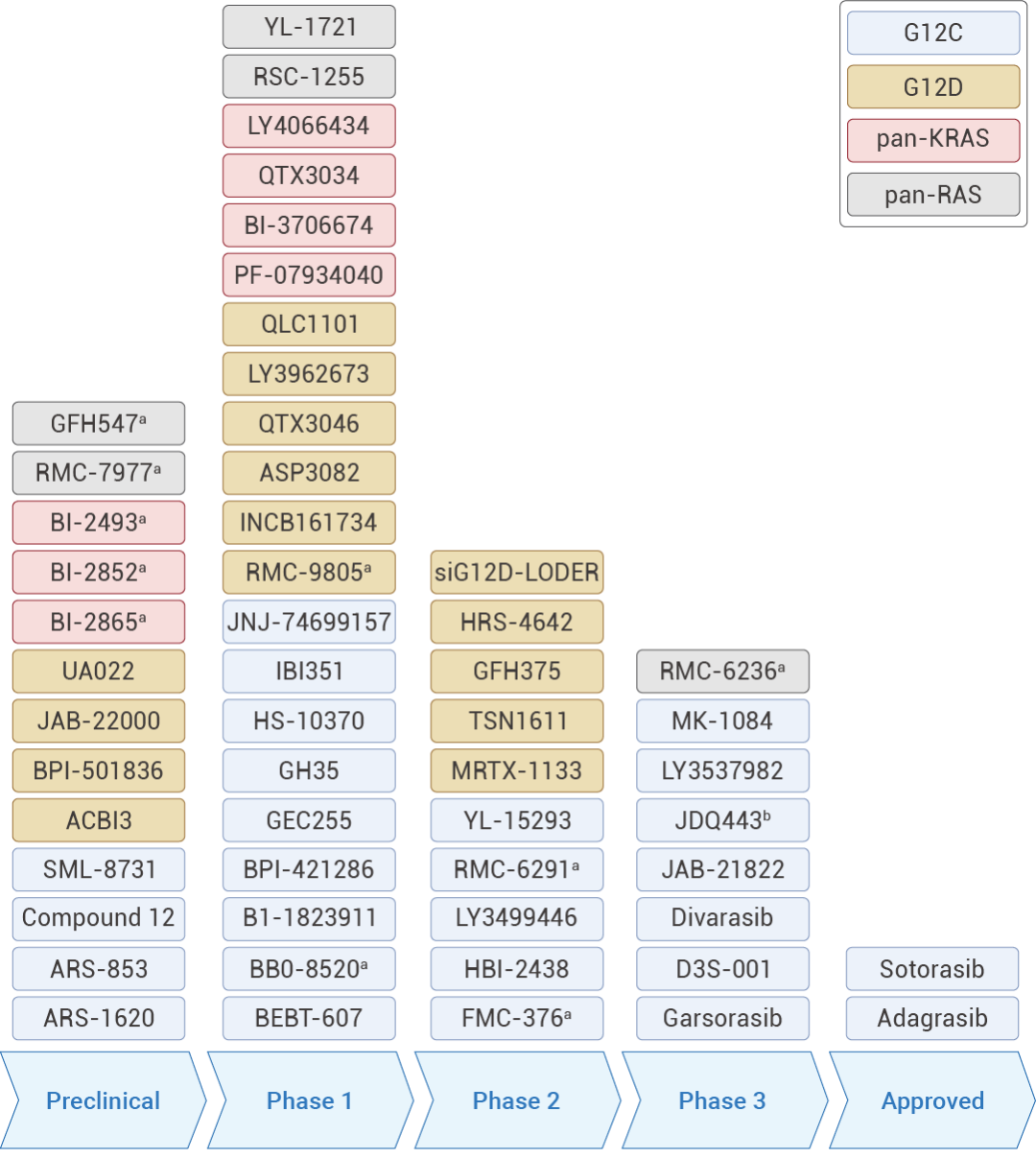 图 3. 临床在研的 RAS 抑制剂
[5]
。
图 3. 临床在研的 RAS 抑制剂
[5]
。
靶向 G12C 的抑制剂共价结合到 KRAS G12C 突变体中的半胱氨酸残基,使蛋白质稳定在非活性的 GDP 结合状态。遗憾的是,这一策略不适用于 KRAS G12D ,因为 KRAS G12D 突变体中的天冬氨酸残基的羧基亲核性弱于半胱氨酸的巯基 [2] 。这种差异导致了如 MRTX849 等化合物对 KRAS G12C 具有显著作用,但对 KRAS G12D 没有影响。
由于无法直接靶向,Mirati Therapeutics 公司基于 MRTX849 的结构将烯酰胺基团替换为哌嗪基团开发出了 MRTX1133 [2][3]。MRTX1133 的哌嗪基团与 KRAS G12D 的天冬氨酸残基之间形成离子键从而实现非共价结合。MRTX1133 与 KRAS G12D 的非共价结合阻止了核苷酸交换和效应 RAF 的结合,抑制了 KRAS 下游通路激活所必需的蛋白质-蛋白质相互作用[2][3]。由于 MRTX-1133 的设计是基于 MRTX849 的结构,因此其他靶向 G12C 的药物也可以经过修饰,使其对 G12D 突变的癌症具有反应性。
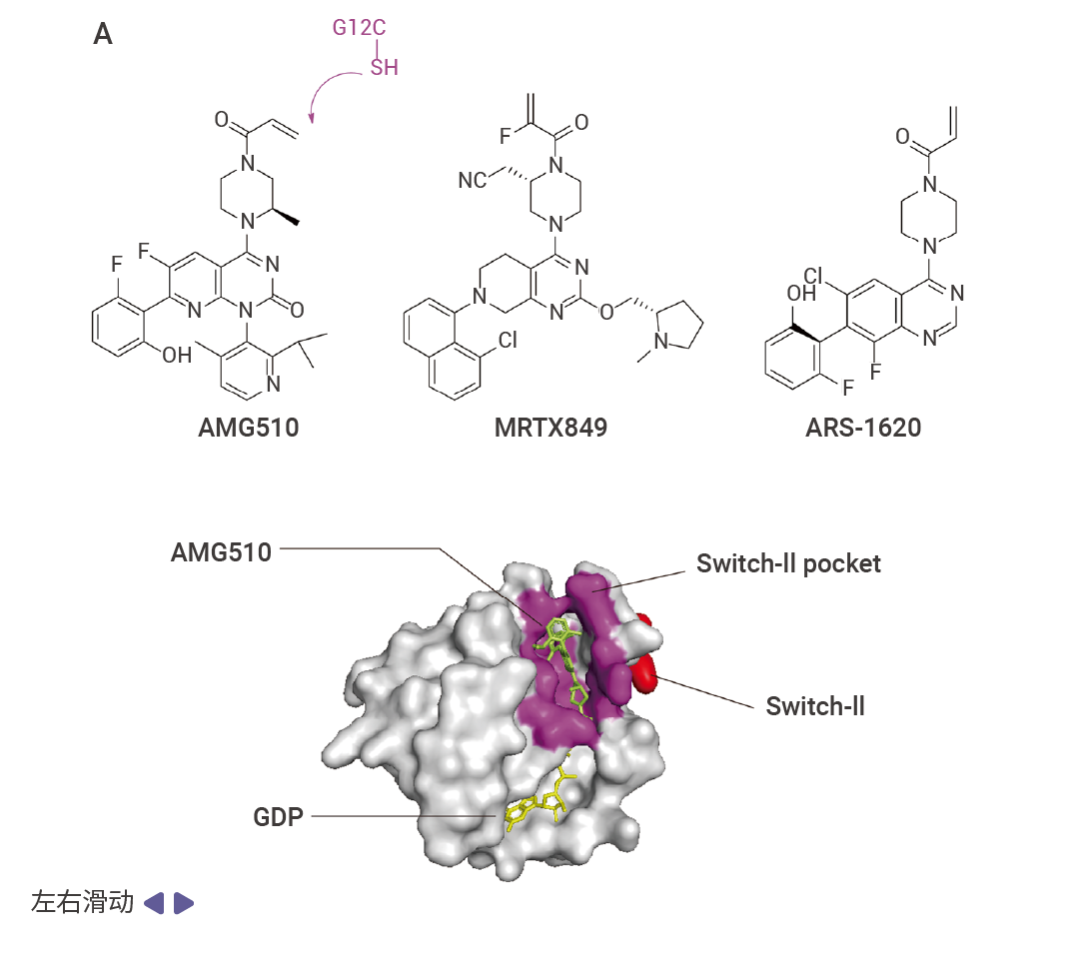
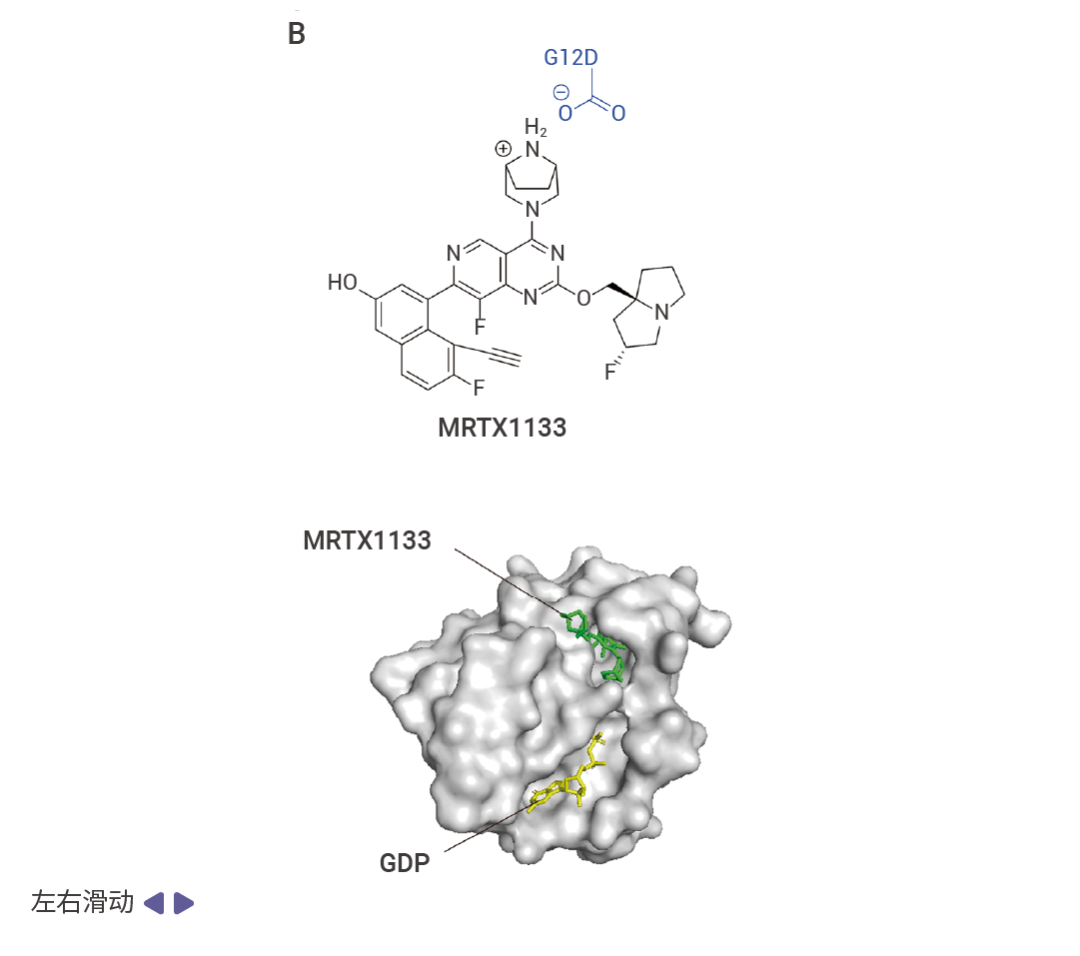
图 4. KRAS 突变抑制剂与 KRAS 结合示意图 [2] 。
A. AMG510 与 KRAS G12C 的 Switch-II 口袋(紫色)结合;B. MRTX1133 与 KRAS G12D 结合。
RMC-9805 的开发策略与 MRTX1133 不同。RMC-9805 首先在 KRAS G12D 与亲环素 A 之间形成非共价键,从而形成 KRAS、亲环素 A 和 RMC-9805 的三元复合物,导致 RMC-9805 与天冬氨酸缓慢地共价结合,阻断 KRAS 效应蛋白的不可逆下游结合[3]。这种相互作用通过破坏 KRAS G12D 的下游信号效应分子 (如 RAF),选择性且持续地修饰 KRAS G12D,从而诱导细胞凋亡并抑制细胞增殖。
在接受至少 14 周 RMC-9805 治疗的 KRAS G12D 突变的胰腺导管腺癌患者中,客观缓解率 (ORR) 为 30% (n=12) ,疾病控制率 (DCR) 为 80% ( n=32) [ 11] 。此外,RMC-9805 显示出了出色的安全性特征,并且在不同剂量下总体耐受性良好。这些结果表明,RMC-9805 具有令人鼓舞的临床表现。
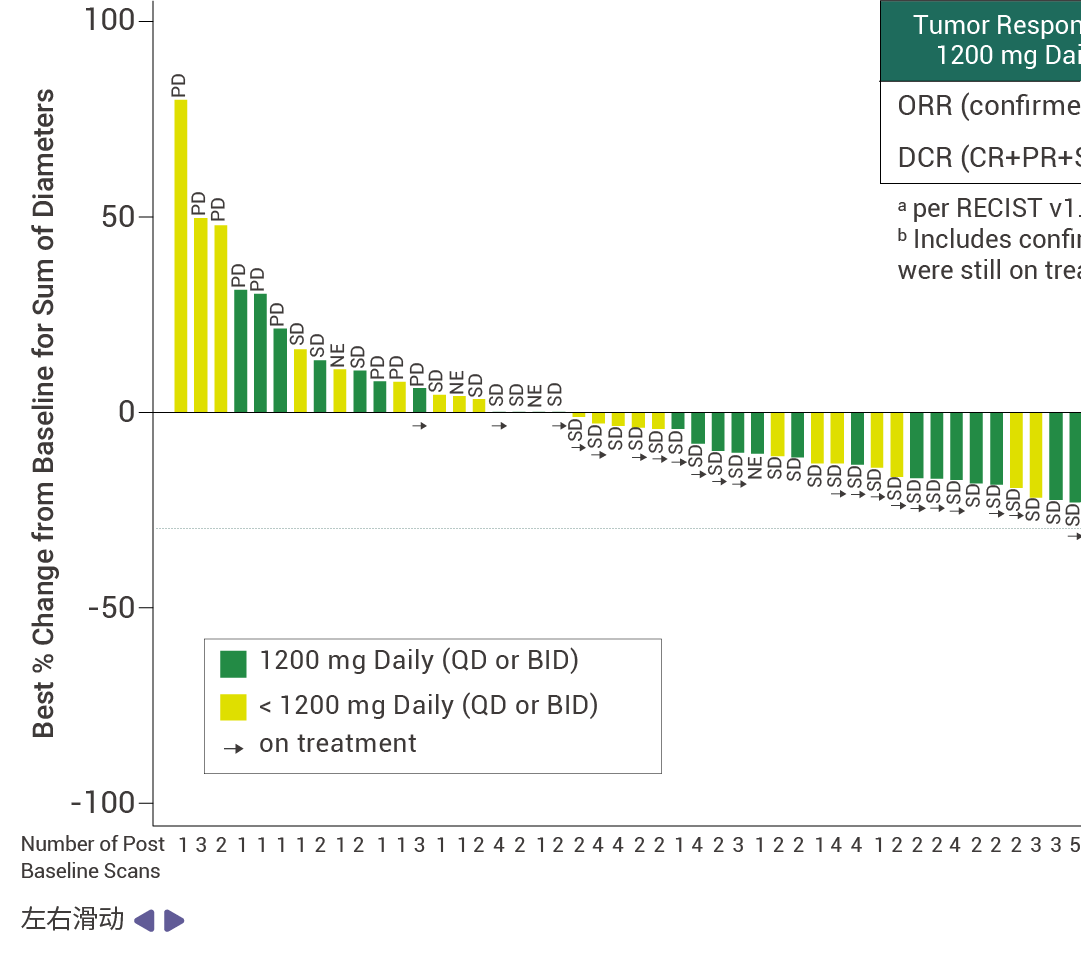
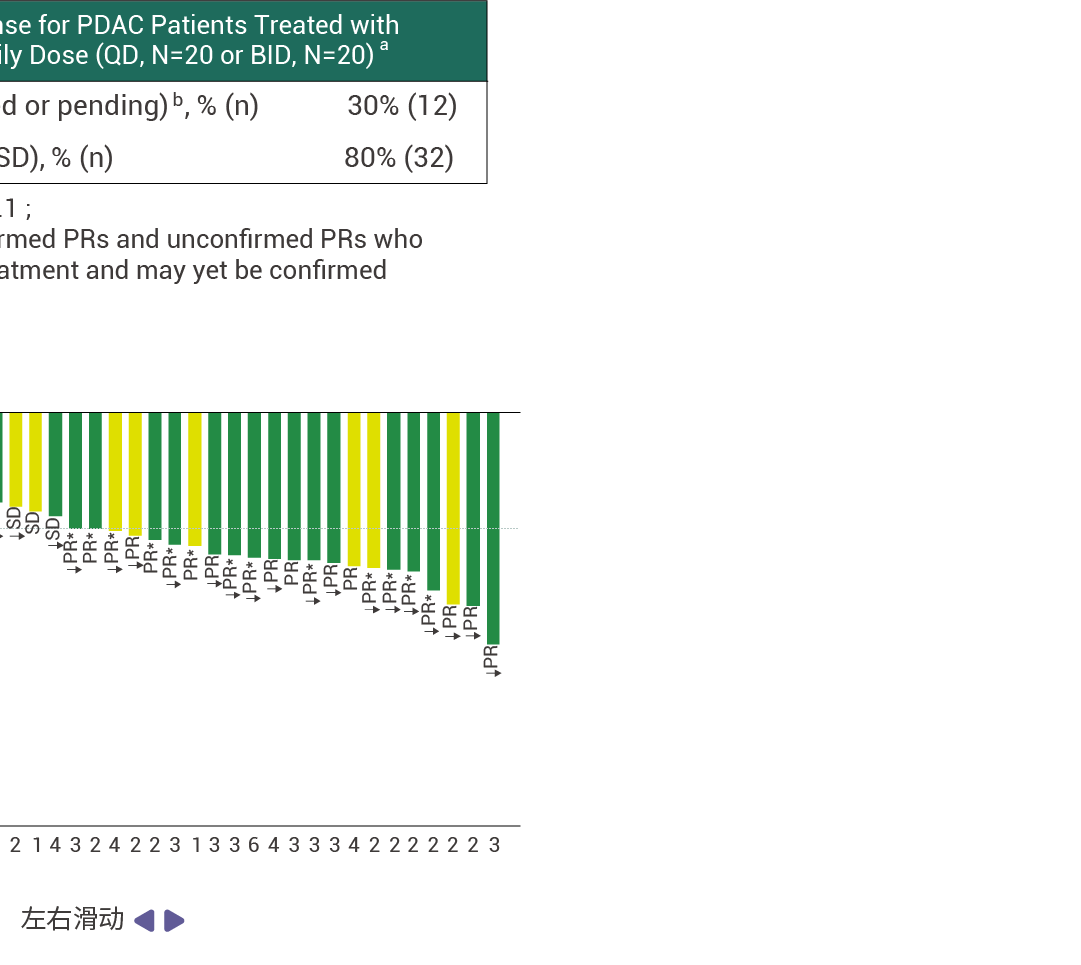
图 5. RMC-9805 对胰腺导管腺癌患者具有抗肿瘤活性 [11] 。
MRTX1133 和 RMC-9805 只在 KRAS G12D (ON;GTP 结合) 处于活性状态时与其结合。相比之下,VS-7375 (GFH375) 在活性状态和非活性状态 (OFF;GDP 结合) 下都能与 KRAS G12D 结合。因此,与仅在活性状态或仅在非活性状态下抑制 KRAS G12D 的化合物相比,VS-7375 更有可能更完全地抑制 KRAS G12D 信号传导和肿瘤生长。VS-7375 在体内多种 KRAS G12D 肿瘤模型中作为单药或与包括 cetuximab 在内的其他抗癌药物联合使用时都表现出良好的抗肿瘤活性 [12] 。这些结果支持对 VS-7375 用于治疗 KRAS G12D 突变癌症患者的临床评估。
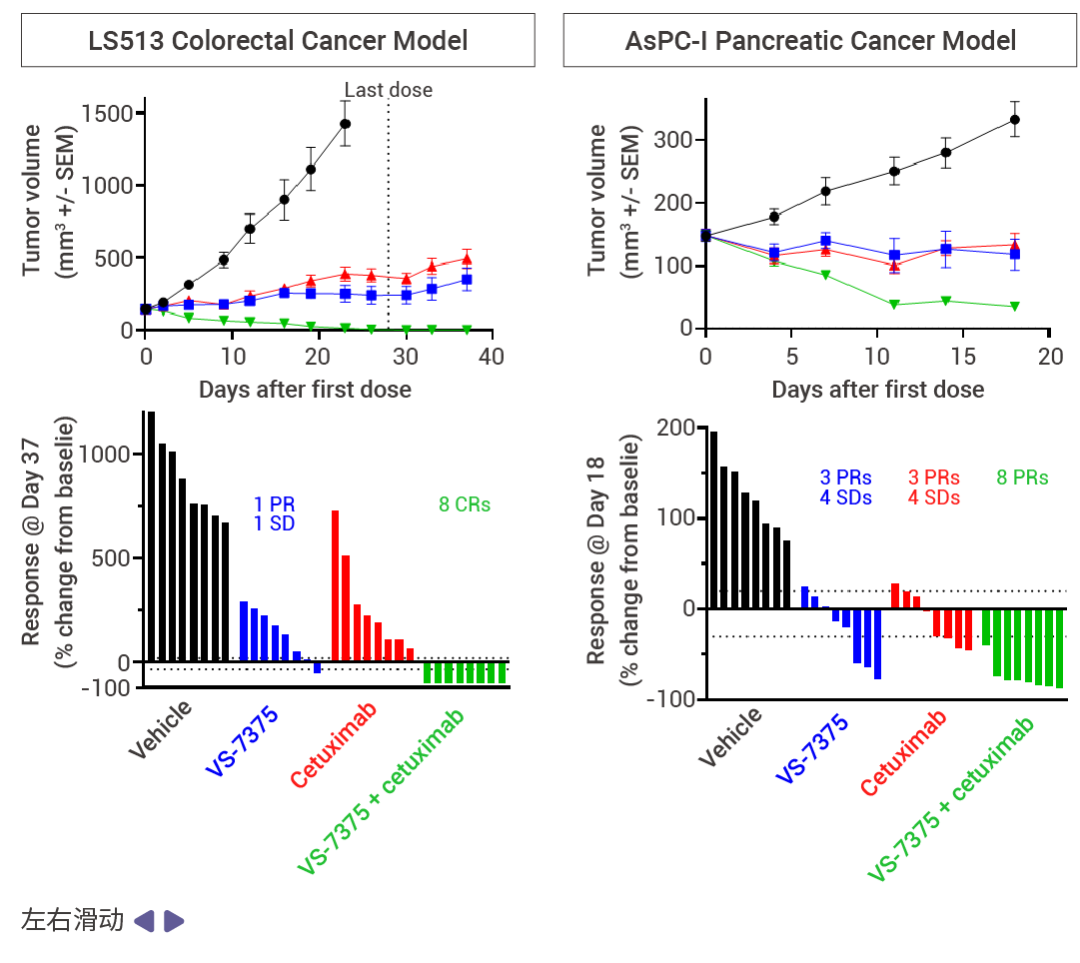
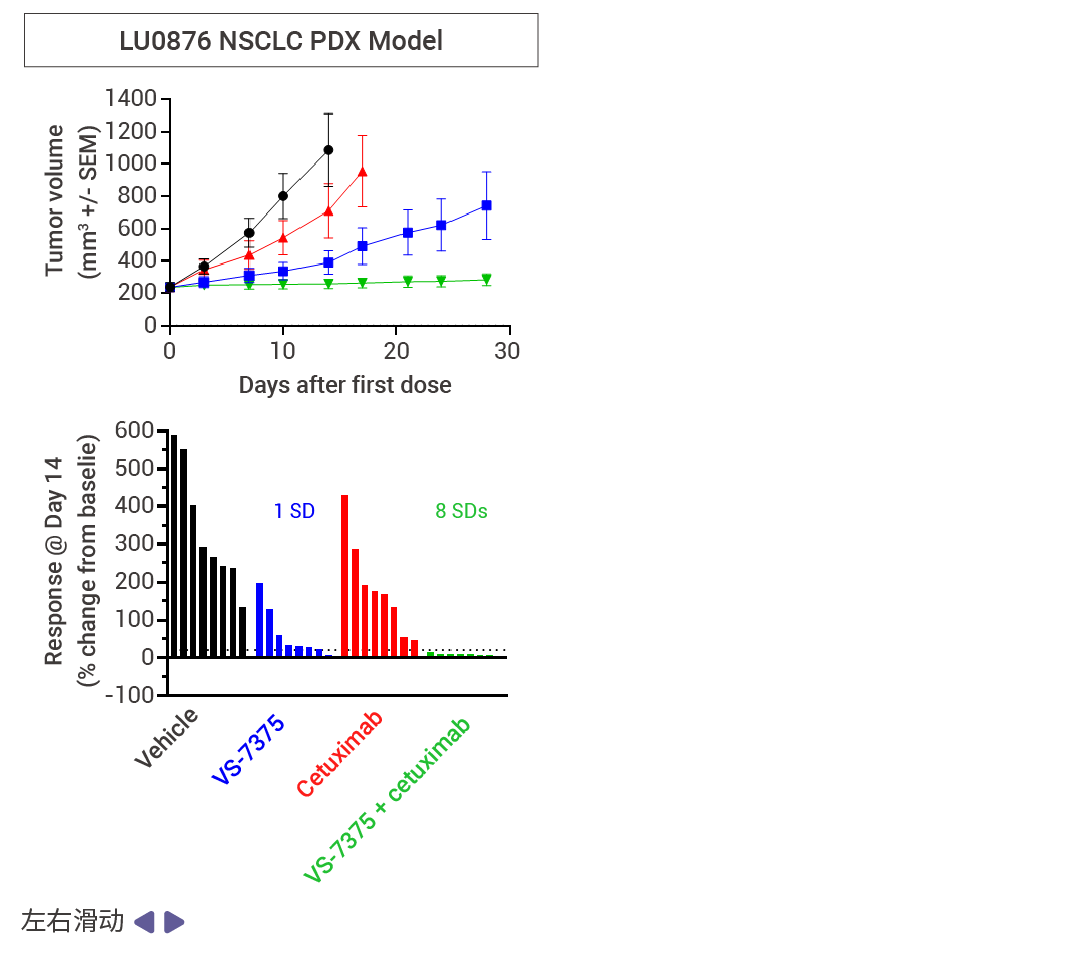
图 7. 使用 VS-7375 或 cetuximab 治疗接种了 LS513, AsPC-1 或 LU876 细胞(KRAS G12D 突变)的小鼠 [12] 。
其他 KRAS G12D 抑制剂包括 HRS-4642 、TH-Z835、JAB-22000 和 ERAS-4 等也正在开发。还有一种 KRAS G12D 降解剂 ASP3082 通过将 KRAS G12D 与 E3 泛素连接酶结合促进蛋白降解[3]。
Section.04
小结
特异性 KRAS G12C 抑制剂改变了 KRAS 突变癌症的治疗格局,使许多 KRAS 突变癌症患者受益。不幸的是,对 KRAS 抑制剂的先天和获得性耐药阻碍了它们的发展,使这些新药的疗效降低甚至无效。作为常见的 KRAS 突变之一。KRAS G12D 驱动高度免疫抑制的肿瘤微环境,并表现出强大的致癌潜力。因此,开发 KRAS G12D 抑制剂以及其他泛 KRAS 抑制剂是 KRAS 靶向治疗的新方向。
| 产品推荐 |
| Sotorasib (AMG-510) 是一种有效的,口服生物可利用的,选择性的 KRAS G12C 共价抑制剂。Sotorasib 将 KRAS G12C 锁定在非活跃的 GDP 约束状态。Sotorasib 导致 KRAS G12C 突变的局部晚期或转移性非小细胞肺癌 (NSCLC) 的消退。 |
| Adagrasib (MRTX849) 是一种有效,口服可用,突变选择性的 KRAS G12C 共价抑制剂,具有潜在抗肿瘤活性的。Adagrasib 在半胱氨酸 12 残基处与 KRAS G12C 共价结合,将蛋白锁定在非活性的 GDP 结合构象中,并抑制 KRAS 依赖性信号转导。 |
| Fulzerasib (GFH925) 是一种不可逆的 KRAS G12C 抑制剂,与西妥昔单抗 (HY-P9905) 具有协同抗癌作用。 |
| Opnurasib (JDQ-443) (NVP-JDQ443) 是一种口服有效和选择性的共价 KRAS G12C 抑制剂。Opnurasib 具有抗肿瘤活性。 |
| Elisrasib 是口服有效的 KRAS 抑制剂。Elisrasib 抑制 KRAS G12C 突变体 H358 和 MIA-PA-CA-2 的增殖,IC50 分别为 0.6 和 0.44 nM。Elisrasib 在多物种的肝细胞、肝微粒体、血浆和全血中表现出良好的代谢稳定性。Elisrasib 在小鼠中表现出良好的药代动力学特征和抗肿瘤活性。 |

[1] Huang, Lamei et al. Signal Transduct Target Ther. 2021 Nov 15;6(1):386.
[2] Zhu, Chunxiao et al. Mol Cancer. 2022 Aug 4;21(1):159.
[3] Zeissig, Mara N et al. Trends Cancer. 2023 Nov;9(11):955-967.
[4] O'Sullivan, Éabha et al. Cancers (Basel). 2023 Mar 7;15(6):1635.
[5] Isermann, Tamara et al. Trends Cancer. 2025 Feb;11(2):91-116.
[6] Toribio, María Luisa, and Sara González-García. Int J Mol Sci. 2023 Jan 10;24(2):1383.
[7] Prahallad, Anirudh et al. Nature. 2012 Jan 26;483(7387):100-3.
[8] Fakih, Marwan G et al. N Engl J Med. 2023 Dec 7;389(23):2125-2139.
[9] Yaeger, Rona et al. Cancer Discov. 2024 Jun 3;14(6):982-993.
[10] Hofmann, Marco H et al. Cancer Discov. 2022 Apr 1;12(4):924-937.
[11] Pancreatic Cancer Update. Retrieved October 25, 2024.
[12] VS-7375 (GFH375): An oral, selective KRAS G12D (ON/OFF) inhibitor with potent anti-tumor efficacy as single agent and in combination with other anticancer therapies in preclinical models.


本站“ABIO生物试剂品牌网”图片文字来自互联网
如果有侵权请联系微信: nanhu9181 处理,感谢~





