HDX-MS助力揭示FXR-RXRα与SRC1的互作机制_abio生物试剂品牌网
客户文章
最/新研究成果展示 ▶ 发表时间:2025年3月13日 ▶ 期刊:《Communications Biology》(JCR1区) ▶ 发表团队:广州生物医药健康研究院刘劲松研究员 ▶ 核心内容:该研究使用揭示了FXR-RXRα与SRC1相互作用的分子机制,提出了首/个包含FXR-RXRα-DNA和SRC1-NRID的多域复合物模型。研究结果不仅为理解核受体复合物的动态调控机制提供了新的视角,还为代谢相关脂肪性肝病(MAFLD)和代谢功能障碍相关脂肪性肝炎(MASH)的治疗提供了新的思路。
 Part1.
Part1.
研究背景:FXR-RXRα与SRC1相互作用的研究难题 FXR(法尼酯X受体)是一种与代谢紊乱相关的核受体,其与RXRα形成的异二聚体在基因转录调控中扮演着重要角色。SRC1作为重要的共激活因子,能够与FXR-RXRα相互作用,进而影响基因表达。然而,这种相互作用的分子机制一直未能完全解析。本研究采用HDX-MS表征技术解决了本研究中最关键的问题,即DNA和激动剂对于FXR-RXRα 和SRC1结合引起的影响。相对于传统的结构生物学技术X-射线衍射难以表征多域结构和动态变化以及冷冻电镜技术则对样品的制备要求极高且成本高昂等问题,HDXMS具有其独特的优势。 Part2.
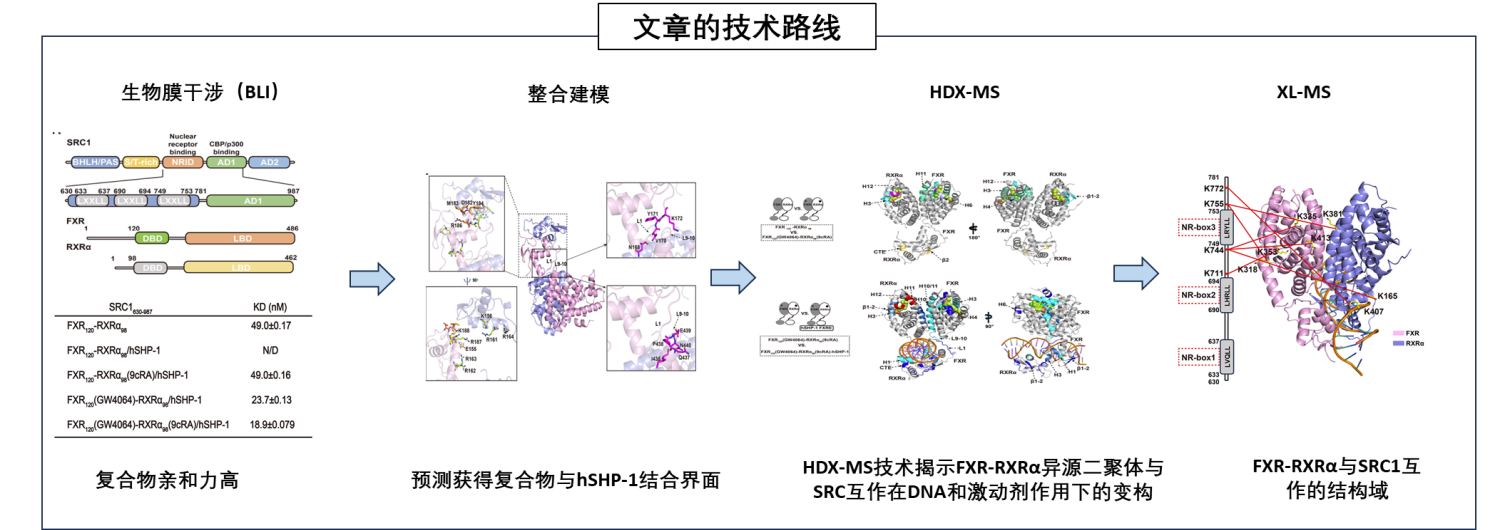
技术路线与结论 ▷ 首先,研究者们使用生物膜干涉(BLI) 实验检测了不同状态下FXR-RXRα与SRC1的结合亲和力(KD值)。结果显示,激动剂和DNA(hSHP-1) 的结合显著影响SRC1与FXR-RXRα的结合能力,结合水平在nM水平,表明亲和力较高。 ▷ 接着,通过整合建模方法预测FXR-RXRα-hSHP-1可能的互作区域。 ▷ 进一步的,通过HDX-MS实验展示了激动剂和DNA结合对FXR-RXRα构象的影响。结果显示,激动剂结合稳定了FXR的LBD,而DNA结合进一步增强了这种稳定性,并促进了LBD和DBD之间的相互作用。 ▷ 最后,通过交联质谱等实验,进一步验证FXR-RXRα与SRC1互作的精细互作区域位于SRC2的NR-box3结构域。
 Part3.
Part3.
HDX-MS 技术揭示动态调控机制 HDX-MS技术能检测蛋白质在不同条件下氢原子与氘原子的交换速率,揭示蛋白质结构的稳定性和灵活性。在这项研究中,HDX-MS技术被用来分析FXR-RXRα在不同状态下的构象变化,包括与激动剂、DNA结合后的变化。
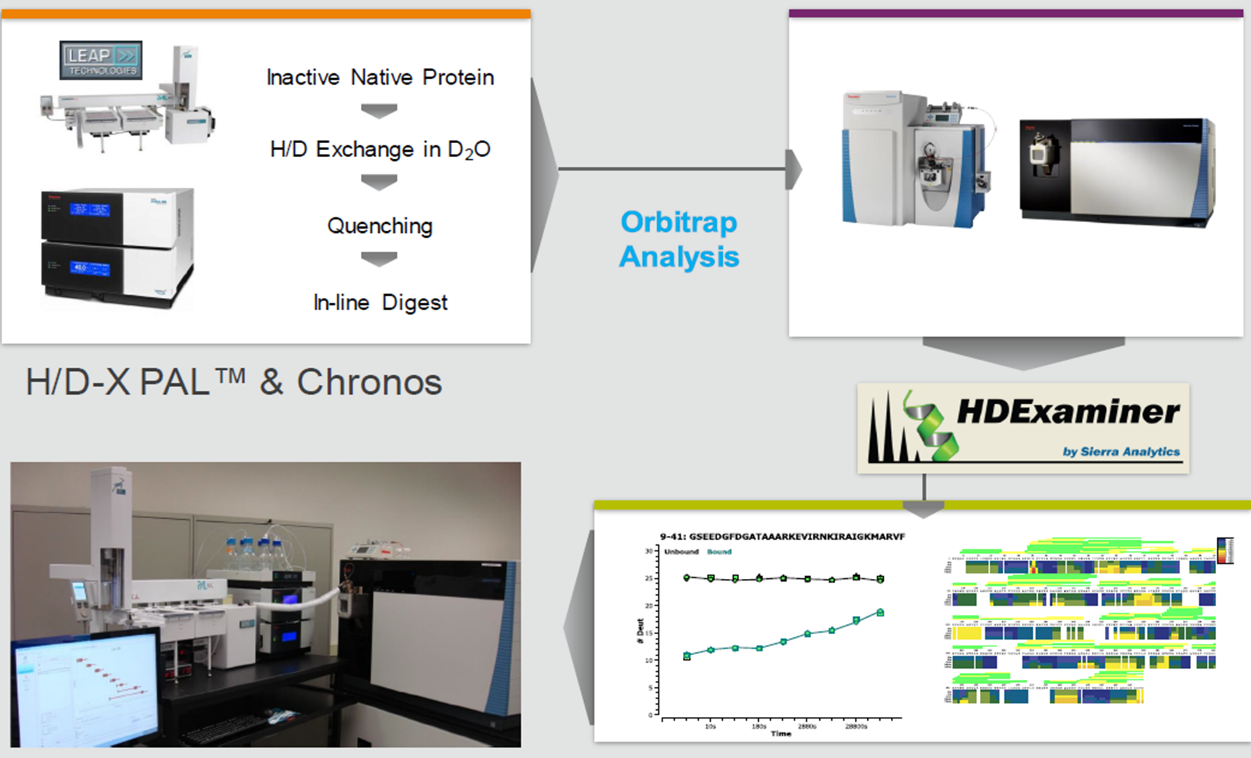 HDX-MS实验与数据分析平台
实验设计: 研究人员制备了三种样品:未结合激动剂的FXR-RXRα、结合激动剂的FXR-RXRα以及结合激动剂和DNA的FXR-RXRα。所有样品均在生理条件下进行处理,以确保实验结果的生理相关性。
实验过程:样品在不同时间点(0秒、10秒、30秒、120秒、600秒和1800秒)进行氘化处理,随后通过质谱分析检测蛋白质肽段的氘化程度。实验重复三次,以确保结果的可靠性。
数据分析:通过比较不同状态下蛋白质肽段的氘化速率,研究人员能够识别出在激动剂和DNA结合后发生显著构象变化的区域。具体结果如下:
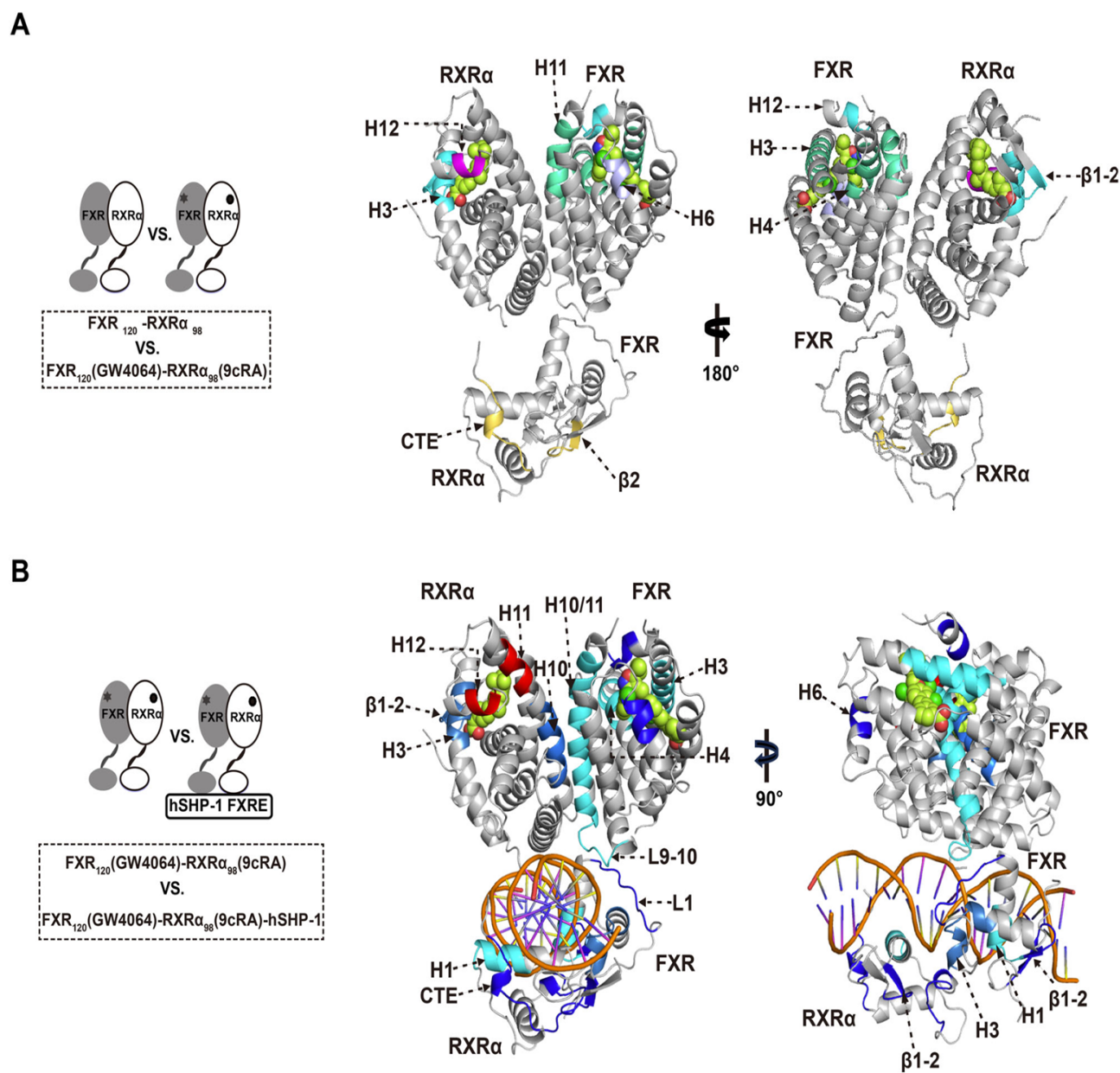
1. 激动剂结合的影响:激动剂结合后,FXR的H3、H4、H6和H12区域的氘化速率显著降低,表明这些区域的结构变得更加稳定。这与激动剂结合后形成的共激活因子结合表面的稳定化密切相关。
2. DNA结合的影响:当FXR-RXRα与DNA结合后,其LBD(配体结合域)和DBD(DNA结合域)的氘化速率也发生了显著变化。特别是FXR-LBD的H11和H12区域,其灵活性增加,这可能与共激活因子的招募有关。
3. 整体构象变化:DNA结合进一步稳定了FXR-RXRα的异二聚体界面,增强了LBD之间的二聚化,从而促进了共激活因子的招募。
HDX-MS实验与数据分析平台
实验设计: 研究人员制备了三种样品:未结合激动剂的FXR-RXRα、结合激动剂的FXR-RXRα以及结合激动剂和DNA的FXR-RXRα。所有样品均在生理条件下进行处理,以确保实验结果的生理相关性。
实验过程:样品在不同时间点(0秒、10秒、30秒、120秒、600秒和1800秒)进行氘化处理,随后通过质谱分析检测蛋白质肽段的氘化程度。实验重复三次,以确保结果的可靠性。
数据分析:通过比较不同状态下蛋白质肽段的氘化速率,研究人员能够识别出在激动剂和DNA结合后发生显著构象变化的区域。具体结果如下:
1. 激动剂结合的影响:激动剂结合后,FXR的H3、H4、H6和H12区域的氘化速率显著降低,表明这些区域的结构变得更加稳定。这与激动剂结合后形成的共激活因子结合表面的稳定化密切相关。
2. DNA结合的影响:当FXR-RXRα与DNA结合后,其LBD(配体结合域)和DBD(DNA结合域)的氘化速率也发生了显著变化。特别是FXR-LBD的H11和H12区域,其灵活性增加,这可能与共激活因子的招募有关。
3. 整体构象变化:DNA结合进一步稳定了FXR-RXRα的异二聚体界面,增强了LBD之间的二聚化,从而促进了共激活因子的招募。
 Part4.
Part4.
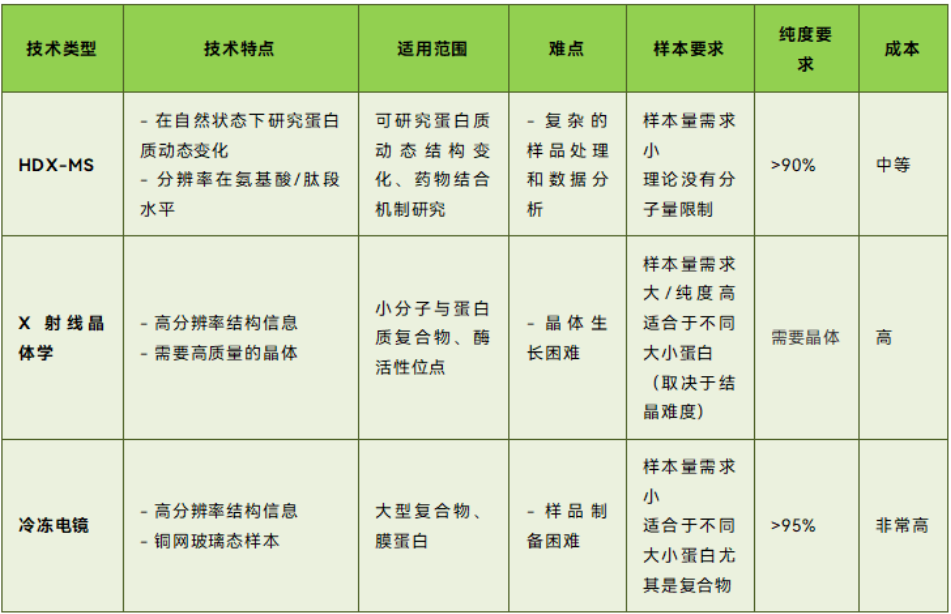
HDX-MS 与传统结构表征技术的比较表.HDX-MS 与传统结构表征技术的比较
本站“ABIO生物试剂品牌网”图片文字来自互联网
如果有侵权请联系微信: nanhu9181 处理,感谢~